En
química, la
estequiometría (del
griego στοιχειον,
stoicheion, 'elemento' y
μετρον,
métrón, 'medida') es el cálculo entre relaciones cuantitativas entre los reactantes y productos en el transcurso de una
reacción química.
[1] [2] Estas relaciones se pueden deducir a partir de la
teoría atómica, aunque históricamente se enunciaron sin hacer referencia a la composición de la materia, según distintas
leyes y principios.
El primero que enunció los principios de la estequiometría fue
Jeremias Benjamin Richter (
1762-
1807), en
1792, quien describió la estequiometría de la siguiente manera:
«La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa de los elementos químicos que estan implicados.» (en una reacción química).Cuando los reactivos de una reacción están en cantidades proporcionales a sus coeficientes estequiométricos se dice:
- La mezcla es estequiométrica;
- Los reactivos están en proporciones estequiométricas;
- La reacción tiene lugar en condiciones estequiométricas;
Las tres expresiones tienen el mismo significado.
En estas condiciones, si la reacción es completa, todos los reactivos se consumirán dando las cantidades estequiométricas de productos correspondientes.
Si no en esta forma, existirá el reactivo limitante que es el que está en menor proporción y que con base en él se trabajan todos los cálculos.
Ejemplo
-
- Masa atómica del oxígeno = 15,9994.
- Masa atómica del carbono = 12,0107.
La reacción es:

para formar una molécula de dióxido de carbono, hacen falta un átomo de carbono y dos de oxígeno, o lo que es lo mismo, un mol de carbono y dos mol de oxígeno.

despejando x:
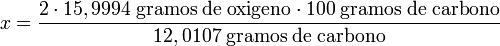
realizadas las operaciones:

Cálculos estequiométricos
Los cálculos estequiométricos se basan en las relaciones fijas de combinación que hay entre las sustancias en las reacciones químicas balanceadas. Estas relaciones están indicadas por los subíndices numéricos que aparecen en las fórmulas y por los coeficientes. Este tipo de cálculos es muy importante y se utilizan de manera rutinaria en el análisis químico y durante la producción de las sustancias químicas en la industria. Los cálculos estequiométricos requieren una unidad química que relacione las masas de los reactantes con las masas de los productos. Esta unidad química es el mol.


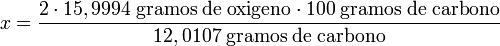

No hay comentarios:
Publicar un comentario