 Ahora recortaremos los flecos sobrantes y quitaremos la cinta de carrocero. Sólo falta respetar el tiempo de secado, que los profesionales del sector denominan ‘curado’, y normalmente será al menos de 24 horas. De esta manera tan sencilla, añadiendo muy poco peso a la estructura, hemos fortalecido el objeto hasta unos límites asombrosos.
Ahora recortaremos los flecos sobrantes y quitaremos la cinta de carrocero. Sólo falta respetar el tiempo de secado, que los profesionales del sector denominan ‘curado’, y normalmente será al menos de 24 horas. De esta manera tan sencilla, añadiendo muy poco peso a la estructura, hemos fortalecido el objeto hasta unos límites asombrosos.viernes, 6 de abril de 2012
practica de poliester 3 por ARIZA MOEDANO ENRIQUE
Seguimos a la caza y captura de burbujas. En las superficies grandes se emplean para este fin rodillos metálicos, de cómodo manejo. El mercado ofrece dos tipos de fibra de vidrio: el tejido y la manta. Para nuestro marco hemos decidido emplear la manta, cuya estructura aglomerada ofrece solidez en cualquier ángulo de tracción.
 Ahora recortaremos los flecos sobrantes y quitaremos la cinta de carrocero. Sólo falta respetar el tiempo de secado, que los profesionales del sector denominan ‘curado’, y normalmente será al menos de 24 horas. De esta manera tan sencilla, añadiendo muy poco peso a la estructura, hemos fortalecido el objeto hasta unos límites asombrosos.
Ahora recortaremos los flecos sobrantes y quitaremos la cinta de carrocero. Sólo falta respetar el tiempo de secado, que los profesionales del sector denominan ‘curado’, y normalmente será al menos de 24 horas. De esta manera tan sencilla, añadiendo muy poco peso a la estructura, hemos fortalecido el objeto hasta unos límites asombrosos.
 Ahora recortaremos los flecos sobrantes y quitaremos la cinta de carrocero. Sólo falta respetar el tiempo de secado, que los profesionales del sector denominan ‘curado’, y normalmente será al menos de 24 horas. De esta manera tan sencilla, añadiendo muy poco peso a la estructura, hemos fortalecido el objeto hasta unos límites asombrosos.
Ahora recortaremos los flecos sobrantes y quitaremos la cinta de carrocero. Sólo falta respetar el tiempo de secado, que los profesionales del sector denominan ‘curado’, y normalmente será al menos de 24 horas. De esta manera tan sencilla, añadiendo muy poco peso a la estructura, hemos fortalecido el objeto hasta unos límites asombrosos.practica de poliester 2 por ARIZA MOEDANO ENRIQUE
practica de poliester por ARIZA MOEDANO ENRIQUE
polimeros por ARIZA MOEDANO ENRIQUE
¿Qué son los polímeros?
La materia esta formada por moléculas que pueden ser de tamaño normal o moléculas gigantes llamadas polímeros.
Los polímeros se producen por la unión de cientos de miles de moléculas pequeñas denominadas monómeros que forman enormes cadenas de las formas más diversas. Algunas parecen fideos, otras tienen ramificaciones. algunas más se asemejan a las escaleras de mano y otras son como redes tridimensionales.
Existen polímeros naturales de gran significación comercial como el algodón, formado por fibras de celulosas. La celulosa se encuentra en la madera y en los tallos de muchas plantas, y se emplean para hacer telas y papel. La seda es otro polímero natural muy apreciado y es una poliamida semejante al nylon. La lana, proteína del pelo de las ovejas, es otro ejemplo. El hule de los árboles de hevea y de los arbustos de Guayule, son también polímeros naturales importantes.
Sin embargo, la mayor parte de los polímeros que usamos en nuestra vida diaria son materiales sintéticos con propiedades y aplicaciones variadas.
Lo que distingue a los polímeros de los materiales constituídos por moléculas de tamaño normal son sus propiedades mecánicas. En general, los polímeros tienen una excelente resistencia mecánica debido a que las grandes cadenas poliméricas se atraen. Las fuerzas de atracción intermoleculares dependen de la composición química del polímero y pueden ser de varias clases.
domingo, 4 de marzo de 2012
NOMENCLATURA DE CETONAS POR ENRIQUE ARIZA MOEDANO
Cetonas
 propanona butanone 2-pentanona
propanona butanone 2-pentanona
- Se considera la cadena mayor la que contiene el grupo carbonilo como base y la terminación "o" del alcano correspondiente se cambia por "ona".
- Las posiciones de los sustituyentes se indican mediante números, utilizando el menor número posible para el grupo carbonilo.

NOMENCLATURA DE CETONAS POR ENRIQUE ARIZA MOEDANO
Cetonas
 propanona butanone 2-pentanona
propanona butanone 2-pentanona
- Se considera la cadena mayor la que contiene el grupo carbonilo como base y la terminación "o" del alcano correspondiente se cambia por "ona".
- Las posiciones de los sustituyentes se indican mediante números, utilizando el menor número posible para el grupo carbonilo.

NOMENCLATURA DE ALDEHIDOS POR ENRIQUE ARIZA MOEDANO
Aldehídos
2-metilpentanal 3-metilpentanal
- La cadena mayor que contiene al grupo funcional –CHO, se considera como base para nombrar al compuesto.
- La terminación "o" del alcano, se cambia por "al".
- Las posiciones de los sustituyentes, se indican mediante los números menores posible, reservando el 1 para el carbono carbonílico.
2-metilpentanal 3-metilpentanal
NOMENCLATURA DE ALCOHOLES POR ENRIQUE ARIZA MOEDANO
Alcoholes
 metanol etanol 1-propanol 2-propanol
metanol etanol 1-propanol 2-propanol
 3-metil-2-butanol 6-metil-4-octanol
3-metil-2-butanol 6-metil-4-octanol
- Se elige la cadena más larga que contiene el grupo hidroxilo (cadena fundamental). Esto forma la base del nombre del compuesto, cambiando la terminación "o" del hidrocarburo correspondiente por el sufijo "ol".
- La numeración de la cadena fundamental se realiza de modo que la posición del hidroxilo quede establecida por el número menor posible.
- Se nombran las ramificaciones y sustituyentes indicando sus posiciones mediante números.


NOMENCLATURA DE ALQUINOS POR ENRIQUE ARIZA MOEDANO
Alquinos
Las reglas son exactamente las mismas que para nombrar los alquenos, excepto que la terminación "ino", reemplaza la de "eno". La estructura principal es la cadena continua más larga que contiene el triple enlace, y las posiciones de los sustituyentes y el triple enlace son indicadas por números.
El triple enlace se localiza numerando el primer carbono que contiene el triple enlace, comenzando por el extremo de la cadena más cercano al triple enlace.
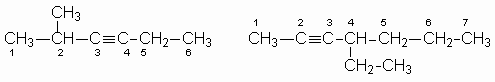 2 - metil – 3 – hexino 4 - etil – 2 – heptino
2 - metil – 3 – hexino 4 - etil – 2 – heptino
Las reglas son exactamente las mismas que para nombrar los alquenos, excepto que la terminación "ino", reemplaza la de "eno". La estructura principal es la cadena continua más larga que contiene el triple enlace, y las posiciones de los sustituyentes y el triple enlace son indicadas por números.
El triple enlace se localiza numerando el primer carbono que contiene el triple enlace, comenzando por el extremo de la cadena más cercano al triple enlace.
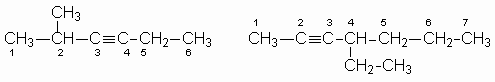
NOMENCLATURA DE ALQUENOS POR ENRIQUE ARIZA MOEDANO
Alquenos
Al igual que en los alcanos, para nombrar los alquenos se siguen una serie de reglas:
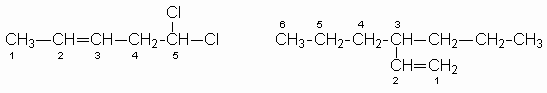 5,5 – dicloro – 2 – penteno 3 – propil – 1- hexeno
5,5 – dicloro – 2 – penteno 3 – propil – 1- hexeno
Al igual que en los alcanos, para nombrar los alquenos se siguen una serie de reglas:
- Para el nombre base se escoge la cadena continua de átomos de carbono más larga que contenga al doble enlace.
- La cadena se numera de tal manera que los átomos de carbono del doble enlace tengan los números más bajos posibles.
- Para indicar la presencia del doble enlace se cambia la terminación "ano" del nombre del alcano con el mismo número de átomos de carbono de la cadena más larga que contenga el doble enlace por la terminación "eno".
 2- penteno
2- penteno - La posición del doble enlace se indica mediante el número menor que le corresponde a uno de los átomos de carbono del doble enlace. Este número se coloca antes del nombre base:
- Los sustituyentes tales como halógenos o grupos alquilo se indica mediante su nombre y un número de la misma forma que para el caso de los alcanos.
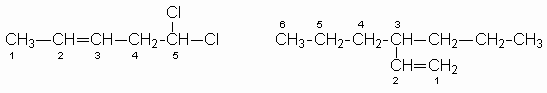
NOMENCLATURA DE ALCANOS POR ENRIQUE ARIZA MOEDANO
Alcanos
Los hidrocarburos de cadena y los hidrocarburos con sustituyentes simples se nombran con el sistema de la IUPAQ de acuerdo con las siguientes reglas:
4-etil-3-metilpentano.
Si en una misma molécula se encuentra presente el mismo sustituyente dos o más veces, el número de sustituyentes iguales se indica mediante los prefijos di, tri, tetra, penta, etc. unidos al nombre del sustituyente. La posición de cada sustituyente se indica mediante un número y varios números se separan mediante comas.
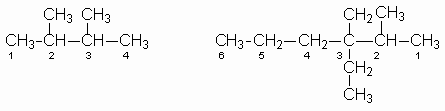 2,3 – dimetilbutano 3,3 – dietil – metilhexano
2,3 – dimetilbutano 3,3 – dietil – metilhexano
Los hidrocarburos de cadena y los hidrocarburos con sustituyentes simples se nombran con el sistema de la IUPAQ de acuerdo con las siguientes reglas:
- El sufijo que designa a un alcano es "ano". Para el siguiente compuesto el nombre base es heptano, ya que la cadena continua más larga tiene siete átomos de carbono. La cadena continua más larga no necesariamente debe ser parte de la molécula escrita en forma horizontal)

- Se escoge la cadena con el mayor número de átomos de carbono unidos de forma continua. El nombre del alcano de cadena continua (ver anexo 1) de la molécula que tenga el mismo número de átomos de carbono que hay en esta cadena más larga, sirve como nombre base de la molécula. Si la cadena básica del compuesto se enumera como se indica, habrá sustituyentes en los C3 y C4. Si se hubiera comenzado la numeración por el otro extremote la cadena, los sustituyentes hubieran quedado en C4 y C5.
Un sustituyente es un átomo o grupo de átomos distintos de hidrógeno y se encuentra unido a un carbono de la cadena más larga. Un sustituyente es un átomo o grupo de átomo, distintos del hidrógeno, y se encuentran unidos a un carbono de la cadena más larga. - Numérese los átomos de carbono de esta cadena continua. La numeración debe comenzar por el extremo que dé los números menores para los átomos que llevan sustituyentes. La presencia de un grupo metilo (CH3-) sobre C3 se indica así: 3-metil y la presencia del grupo etilo (CH3-CH2-) sobre C4 se indica así: 4-etil (la nomenclatura para los grupos sustituyentes formados a partir de los alcanos, los llamamos grupos alquilos, (ver anexo 2).
- Cada sustituyente se nombra indicando su posición mediante un número que corresponde al átomo de carbono al cual se encuentra unido.
- El nombre del compuesto se escribe en una sola palabra. Los nombres se separan de los números mediante guiones y los números entre si mediante comas. Los nombres del sustituyente se agregan como prefijos al nombre básico.
4-etil-3-metilpentano.
Si en una misma molécula se encuentra presente el mismo sustituyente dos o más veces, el número de sustituyentes iguales se indica mediante los prefijos di, tri, tetra, penta, etc. unidos al nombre del sustituyente. La posición de cada sustituyente se indica mediante un número y varios números se separan mediante comas.
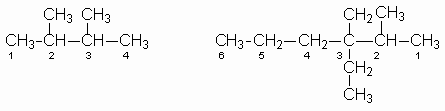

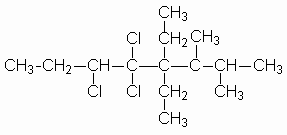
5,5,6 – tricloro - 4,4 – dietil – 2,3 – dimetiloctano
Cada sustituyente debe tener un nombre y un número para localizarlo.
martes, 14 de febrero de 2012
HIDROCARBUROS - Brenda Denisse
HIDROCARBUROS
Los constituyen exclusivamente carbono e hidrógeno.
Dentro de los Hidrocarburos se encuentran los Alifáticos y los Aromáticos.
y dentro de los Alifáticos se encuentran los Alcanos, Alquenos y Alquinos.
HIDROCARBUROS SATURADOS
Alcanos también llamados "parafinas", por su poca afinidad dada su baja reactividad química. Su característica clásica es una ligadura simple entre carbono y carbono.
su fórmula general es la siguiente:
donde n= número de carbonos
QUÍMICA ORGÁNICA - Brenda Denisse García Peralta
TAMBIEN LLAMADA QUIMICA DEL CARBON, MÁS PROPIAMENTE
Surge en el siglo XVII y dedica su área de estudio a los compuestos que producen los seres vivos, de ahí su nombre, “orgánicos”. El químico Alemán Federico Wohler elaboró en 1828 urea, al calentar cianato de potasio (KCNO) y cloruro de amonio (NH4Cl) la urea esta presente en la orina de los seres vivos.
Aunque muchos compuestos orgánicos se obtienen todavía de los seres vivos, hoy en día se obtienen de compuestos sintéticos. Las principales fuentes de materia orgánica son: el petróleo, la hulla, el gas natural, plantas y animales.
La mayoría de las sustancias organices son combustibles, por lo que se utilizan como energéticos en la industria, la casa, el transporte y en la alimentación de los seres vivos.
El carbono por encontrarse dentro de la familia IVA, posee cuatro electrones en su último nivel principal de la energía. Por lo tanto, se considera tetravalente.
Los cuatro enlaces del carbono se orientan hacia los vértices de un tetraedro regular y forman un ángulo de enlace entre ellos de 109 °.
El carbón tiene la propiedad de unirse con otros átomos no metálicos para formar enlaces covalentes. Inclusive se puede unir consigo mismo y forma enlaces covalentes sencillos, dobles o triples.
QUÍMICA ORGÁNICA
TAMBIEN LLAMADA QUIMICA DEL CARBON, MÁS PROPIAMENTE
Surge en el siglo XVII y dedica su área de estudio a los compuestos que producen los seres vivos, de ahí su nombre, “orgánicos”. El químico Alemán Federico Wohler elaboró en 1828 urea, al calentar cianato de potasio (KCNO) y cloruro de amonio (NH4Cl) la urea esta presente en la orina de los seres vivos.
Aunque muchos compuestos orgánicos se obtienen todavía de los seres vivos, hoy en día se obtienen de compuestos sintéticos. Las principales fuentes de materia orgánica son: el petróleo, la hulla, el gas natural, plantas y animales.
La mayoría de las sustancias organices son combustibles, por lo que se utilizan como energéticos en la industria, la casa, el transporte y en la alimentación de los seres vivos.
El carbono por encontrarse dentro de la familia IVA, posee cuatro electrones en su último nivel principal de la energía. Por lo tanto, se considera tetravalente.

Los cuatro enlaces del carbono se orientan hacia los vértices de un tetraedro regular y forman un ángulo de enlace entre ellos de 109 °.

El carbón tiene la propiedad de unirse con otros átomos no metálicos para formar enlaces covalentes. Inclusive se puede unir consigo mismo y forma enlaces covalentes sencillos, dobles o triples.

martes, 17 de enero de 2012
hibridacion y numeros cuanticos por sriza moedano enrique
Hibridación y números cuánticos
En química, se habla de hibridación cuando en un átomo se mezcla varios orbitales atómicos para formar nuevos orbitales híbridos. Los orbitales híbridos explican la forma en que se disponen los electrones en la formación de los enlaces, dentro de la teoría del enlace de valencia, y justifican la geometría las moléculas.
Orbitales
Los electrones de un átomo tienen la tendencia de ubicarse en orbitales específicos alrededor del núcleo, lo cual se enuncia en la ecuación de Schrödinger. Los detalles sobre número y orientación de electrones en cada orbital depende de las propiedades energéticas descritas por los números cuánticos. El primer orbital, el más cercano al núcleo es el llamado 1s y solo puede ser ocupado por dos electrones. Un átomo con un solo electrón (hidrógeno) y uno con dos electrones (helio) ubican su(s) electrón(es) en este orbital.
Un átomo con 3 (litio) y cuatro (berilio) electrones tendrá que ubicar el tercer y cuarto electrón en el siguiente orbital, llamado 2s, el cual también solo acepta dos electrones.
El átomo de carbono tiene seis electrones: dos se ubican en el orbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón):
Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es extraido y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno:
El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidad de llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados sp3 (un poco de ambos orbitales):
De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°.
Se define como la combinacion de un orbital S y 2 P, para formar 3 orbitales híbridos, que se disponen en un plano formando ángulos de 120º.
Los átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace sigma y un enlace pi (π). Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
Tridimensionalmente, la distancia entre un hidrógeno y otro en algún carbono del etileno son equivalentes e iguales a un ángulo de 120°.
Se define como la combinacion de un orbital S y un P, para formar 2 orbitales híbridos, con orientacion lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):
se caracteriza por la presencia de 2 orbitales pi(π).
Los números cuánticos son valores numéricos que nos indican las características de los electrones de los átomos, esto esta basado desde luego en la teoría atómica de Neils Bohr que es el modelo atómico mas aceptado y utilizado en los últimos tiempos.
Los números atómicos más importantes son cuatro:
Número Cuántico Principal.
Número Cuántico Secundario.
Número Cuántico Magnético.
Número Cuántico de Spin.
Número Cuántico Principal (n)
El número cuántico principal nos indica en que nivel se encuentra el electrón, este valor toma valores enteros del 1 al 7.
Número Cuántico Secundario (d)
Este número cuántico nos indica en que subnivel se encuentra el electrón, este número cuántico toma valores desde 0 hasta (n - 1), según el modelo atómico de Bohr - Sommerfield existen además de los niveles u orbitas circulares, ciertas órbitas elípticas denominados subniveles. Según el número atómico tenemos los numeros:
l = 0 s sharp
l = 1 p principal
l = 2 d diffuse
l = 3 f fundamental
l = 4 g
l = 5 h
l = 6 i
Número Cuántico Magnético (m)
El número cuántico magnético nos indica las orientaciones de los orbitales magnéticos en el espacio, los orbitales magnéticos son las regiones de la nube electrónica donde se encuentran los electrones, el número magnético depende de l y toma valores desde -l hasta l.
Número Cuántico de Spin (s)
El número cuántico de spin nos indica el sentido de rotación en el propio eje de los electrones en un orbital, este número toma los valores de −1/2 y de 1/2.
De esta manera entonces se puede determinar el lugar donde se encuentra un electrón determinado, y los niveles de energía del mismo, esto es importante en el estudio de las radiaciones, la energía de ionización, así como de la energía liberada por un átomo en una reacción.
Principio de Exclusión de Pauli
El mismo dice “En un mismo átomo no puede existir dos electrones que tengan los mismos números cuánticos” de esta manera podemos entonces afirmar que en un mismo orbital no puede haber más de dos electrones y que los mismos deben tener distinto número de spin.
Regla de Hund
Cuando se llena orbitales con un mismo nivel de energía o lo que es lo mismo que se encuentran en un mismo subnivel se debe empezar llenando la mitad del subnivel con electrones de spin +1/2 para luego proceder a llenar los subniveles con electrones de spin contrario (−1/2).
domingo, 15 de enero de 2012
REGLAS PARA LA CONFIGURACION ELECTRONICA
El conocimiento de la distribución de los electrones en los distintos orbitales es muy imporante para entender las propiedades de los átomos. Esta información se obtiene a partir de los espectros atómicos y se expresa mediante la configuración electrónica.
De manera aproximada la configuración electrónica de un elemento en su estado fundamental se puede determinar aplicando las siguientes reglas:
Principio de construcción (Aufbau): En su estado fundamental la distribución electrónica de un elemento se construye a partir del inmediato anterior, adicionándole un electrón de modo que le confiera la máxima estabilidad (menor energía)  | Principio de exclusión de Pauli: En un determinado sistema cuántico (átomo o molécula) no pueden existir dos electrones con los cuatro números cuánticos idénticos Por tanto, en un orbital sólo caben dos electrones que compartirían tres números cuánticos y se diferenciarían en el número cuántico de spin (s)  | Regla de la máxima multiplicidad de Hund: Cuando una serie de orbitales de igual energía (p, d , f) se están llenando con electrones, éstos permanecerán desapareados mientras sea posible, manteniendo los espines paralelos  |
FORMAS DE LOS ORBITALES
Por simplicidad, se recogen las formas de la parte angular de los orbitales, obviando los nodos radiales, que siempre tienen forma esférica.
Orbital s
El orbital s tiene simetría esférica alrededor del núcleo atómico. Se muestran dos formas alternativas para representar la nube electrónica de un orbital s: en la primera, la probabilidad de encontrar al electrón (representada por la densidad de puntos) disminuye a medida que nos alejamos del centro; en la segunda, se representa el volumen esférico en que el electrón pasa la mayor parte del tiempo y por ultimo se observa el electrón.
Orbital p
La forma geométrica de los orbitales p es la de dos esferas achatadas hacia el punto de contacto (el núcleo atómico) y orientadas según los ejes de coordenadas. En función de los valores que puede tomar el tercer número cuántico ml (-1, 0 y 1) se obtienen los tres orbitales p simétricos respecto a los ejes x, z e y. Análogamente al caso anterior, los orbitales p presentan n-2 nodos radiales en la densidad electrónica, de modo que al incrementarse el valor del número cuántico principal la probabilidad de encontrar el electrón se aleja del núcleo atómico. El orbital "p" representa también la energía que posee un electrón y se incrementa a medida que se aleja entre la distancia del núcleo y el orbital.
Orbital d
Los orbitales d tienen formas más diversas, cuatro de ellos tienen forma de 4 lóbulos de signos alternados (dos planos nodales, en diferentes orientaciones del espacio), y el último es un doble lóbulo rodeado por un anillo (un doble cono nodal). Siguiendo la misma tendencia, presentan n-3 nodos radiales.
Orbital f
Los orbitales f tienen formas aún más exóticas, que se pueden derivar de añadir un plano nodal a las formas de los orbitales d. Presentan n-4 nodos radiales.
miércoles, 11 de enero de 2012
configuracion electronica por enrike ariza moedano
La configuración electrónica es el modo en el cual los electrones están ordenados en un átomo.
Como los electrones son fermiones están sujetos al principio de exclusión de Pauli, que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente.
En un átomo, los estados estacionarios de la función de onda de un electrón (los estados que son función propia de la ecuación de Schrödinger HΨ = EΨ en donde H es el hamiltoniano) se denominan orbitales, por analogía con la clásica imagen de los electrones orbitando alrededor del núcleo; matemáticamente, sin embargo el orbital, lejos de la concepción planetaria del átomo, es la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima.
Estos estados tienen cuatro números cuánticos: n, l, ml y ms, siendo los dos primeros los más importantes. El principio de exclusión de Pauli, afirma, en resumen que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales.Valores de los números cuánticos.
El primer número cuántico n (llamado a veces número cuántico principal) corresponde a los diferentes niveles de energía permitidos o niveles cuánticos; los valores que toma son 1, 2, 3, 4,... Para n=1 se tiene el nivel de menor energía. En algunos casos (por ejemplo en espectroscopía de rayos X) también se denotan como K, L, M, N,...
El segundo número cuántico l corresponde al momento angular del estado. Estos estados tienen la forma de armónicos esféricos, y por lo tanto se describen usando polinomios de Legendre. A estos subniveles, por razones históricas, se les asigna una letra, y hacen referencia al tipo de orbital (s, p, d, f):
Los valores que puede tomar l son: 0,..., (n-1), siendo n el número cuántico principal.
El tercer número cuántico, ml representa el número de orbitales que contiene el subnivel y puede tomar los valores desde -l a l, habiendo por lo tanto un total de 2l+1 estados posibles. Cada uno de estos puede ser ocupado por dos electrones con spines opuestos, lo que viene dado por el número cuántico ms, que puede valer +1/2 o -1/2. Esto da un total de 2·(2l+1) electrones en total (tal como se puede ver en la tabla anterior).
En resumen, estos son los valores que pueden tomar los números cuánticos:
Se suele emplear una regla mnemotécnica consistente en hacer una tabla en donde en la primera columna se escribe 1s, 2s, 3s,..., en la segunda columna, saltándose una fila, 2p, 3p,... y así sucesivamente. Los primeros niveles que se van llenando con electrones son los que quedan más a la derecha y arriba de la tabla, como indica el sentido de las flechas en el diagrama:
Concretamente, en el diagrama se llenan hasta el 3d, comenzando la primera serie de transición. Si por ejemplo se quiere saber la configuración electrónica del vanadio (Z=23), con el diagrama obtendríamos:
Así, el cobre tiene una estructura electrónica 4s13d10 en vez de la esperada 4s23d9. La razón de ello es que a las fuerzas de atracción entre los protones del núcleo y los electrones, se añade la interferencia de las capas electrónicas interiores que resulta en una desviación de los niveles de energía del último electrón añadido y por tanto una configuración electrónica más estable distinta de la esperada (véase configuración electrónica de los elementos químicos).
Conforme se baja en un grupo de elementos, desde el más ligero al más pesado, los electrones más externos, en niveles de energía más altos, y que por tanto es más fácil que participen en las reacciones químicas, están en el mismo orbital, con una forma parecida, pero con una energía y distancia al núcleo mayores. Por ejemplo, el carbono y el plomo tienen cuatro electrones en sus orbitales más externos.
Debido a la importancia de los niveles energéticos más exteriores, las distintas regiones de la tabla periódica se dividen en bloques, llamándolas según el último nivel ocupado: bloque s, bloque p, bloque d y bloque f.
Como los electrones son fermiones están sujetos al principio de exclusión de Pauli, que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente.
En un átomo, los estados estacionarios de la función de onda de un electrón (los estados que son función propia de la ecuación de Schrödinger HΨ = EΨ en donde H es el hamiltoniano) se denominan orbitales, por analogía con la clásica imagen de los electrones orbitando alrededor del núcleo; matemáticamente, sin embargo el orbital, lejos de la concepción planetaria del átomo, es la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima.
Estos estados tienen cuatro números cuánticos: n, l, ml y ms, siendo los dos primeros los más importantes. El principio de exclusión de Pauli, afirma, en resumen que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales.Valores de los números cuánticos.
El primer número cuántico n (llamado a veces número cuántico principal) corresponde a los diferentes niveles de energía permitidos o niveles cuánticos; los valores que toma son 1, 2, 3, 4,... Para n=1 se tiene el nivel de menor energía. En algunos casos (por ejemplo en espectroscopía de rayos X) también se denotan como K, L, M, N,...
El segundo número cuántico l corresponde al momento angular del estado. Estos estados tienen la forma de armónicos esféricos, y por lo tanto se describen usando polinomios de Legendre. A estos subniveles, por razones históricas, se les asigna una letra, y hacen referencia al tipo de orbital (s, p, d, f):
| Valor de l | Letra | Máximo número de electrones |
|---|---|---|
| 0 | s | 2 |
| 1 | p | 6 |
| 2 | d | 10 |
| 3 | f | 14 |
| 4 | g | 18 |
El tercer número cuántico, ml representa el número de orbitales que contiene el subnivel y puede tomar los valores desde -l a l, habiendo por lo tanto un total de 2l+1 estados posibles. Cada uno de estos puede ser ocupado por dos electrones con spines opuestos, lo que viene dado por el número cuántico ms, que puede valer +1/2 o -1/2. Esto da un total de 2·(2l+1) electrones en total (tal como se puede ver en la tabla anterior).
En resumen, estos son los valores que pueden tomar los números cuánticos:
| Número cuántico | Significado | Valores posibles |
|---|---|---|
| n | Nivel | 1, 2, 3,... |
| l | Subnivel | 0,..., (n-1) |
| ml | Orbital | -l,..., 0,...,+l |
| ms | Spin | -1/2, +1/2 |
Llenado de orbitales y notación.
Para obtener la configuración electrónica de un elemento, los estados se van ocupando por electrones según la energía de estos estados, ocupándose primero los de menor energía. Por el hecho de que el estado 3d (n=3 y l=2) está más alto en energía que el 4s (n=4 y l=0), existen los metales de transición; y como en el orbital d caben 10 electrones según la primera tabla (o bien haciendo l=2 en 2(2l+1)=10), hay diez elementos en cada serie de transición. Lo mismo ocurre con otros bloques de elementos que se pueden ver en la tabla periódica de los elementos.Se suele emplear una regla mnemotécnica consistente en hacer una tabla en donde en la primera columna se escribe 1s, 2s, 3s,..., en la segunda columna, saltándose una fila, 2p, 3p,... y así sucesivamente. Los primeros niveles que se van llenando con electrones son los que quedan más a la derecha y arriba de la tabla, como indica el sentido de las flechas en el diagrama:
Concretamente, en el diagrama se llenan hasta el 3d, comenzando la primera serie de transición. Si por ejemplo se quiere saber la configuración electrónica del vanadio (Z=23), con el diagrama obtendríamos:
- Llenado de orbitales: 1s2 2s2 2p6 3s2 3p6 4s2 3d3 (2 + 2 + 6 + 2 + 6 + 2 + 3 = 23)
Notación.
En la práctica, para simplificar la notación, los niveles de energía completos se indican con la referencia al gas noble correspondiente (el de número atómico inmediatamente menor) al que se añade la distribución de electrones en el nivel no completo. En el caso del vanadio:- Gas noble precendente: 18 Ar: 1s2 2s2 2p6 3s2 3p6
- Configuración eléctrónica del vanadio: [Ar] 4s2 3d3
Configuraciones electrónicas de los elementos químicos.
Aunque la mayoría de las veces los electrones van ocupando los orbitales de la forma indicada anteriormente, en realidad se producen excepciones.Así, el cobre tiene una estructura electrónica 4s13d10 en vez de la esperada 4s23d9. La razón de ello es que a las fuerzas de atracción entre los protones del núcleo y los electrones, se añade la interferencia de las capas electrónicas interiores que resulta en una desviación de los niveles de energía del último electrón añadido y por tanto una configuración electrónica más estable distinta de la esperada (véase configuración electrónica de los elementos químicos).
Bloques de la tabla periódica.
Las propiedades químicas de un átomo dependen mucho de cómo están ordenados los electrones en los orbitales de más energía (a veces llamados de valencia), aparte de otros factores como el radio atómico, la masa atómica, o la accesibilidad de otros estados electrónicos.Conforme se baja en un grupo de elementos, desde el más ligero al más pesado, los electrones más externos, en niveles de energía más altos, y que por tanto es más fácil que participen en las reacciones químicas, están en el mismo orbital, con una forma parecida, pero con una energía y distancia al núcleo mayores. Por ejemplo, el carbono y el plomo tienen cuatro electrones en sus orbitales más externos.
Debido a la importancia de los niveles energéticos más exteriores, las distintas regiones de la tabla periódica se dividen en bloques, llamándolas según el último nivel ocupado: bloque s, bloque p, bloque d y bloque f.
Moléculas.
En las moléculas hay que tratar con los orbitales moleculares y la situación es mucho más compleja.
Suscribirse a:
Entradas (Atom)





